 |
| Vắc-xin Nano Covax chưa đủ dữ liệu để đánh giá hiệu lực |
 |
| Tiêm thử nghiệm vắc-xin Nano Covax trên người tình nguyện |
 |
| Vắc-xin Nano Covax chưa đủ dữ liệu để đánh giá hiệu lực |
 |
| Tiêm thử nghiệm vắc-xin Nano Covax trên người tình nguyện |







(GLO)- Từ loại rau gia vị quen thuộc, rau ngổ đang được nhiều người quan tâm nhờ khả năng hỗ trợ tiêu hóa, thanh nhiệt và lợi tiểu. Bổ sung đúng cách trong bữa ăn có thể mang lại nhiều lợi ích thiết thực cho sức khỏe.

(GLO)- Với tinh thần chủ động, sẵn sàng, vì nhân dân phục vụ, dịp Tết Nguyên đán Bính Ngọ 2026, ngành Y tế tỉnh đã ứng trực, triển khai thực hiện tốt nhiệm vụ, góp phần đem đến một mùa xuân an lành cho cộng đồng.

(GLO)- Acid uric cao là yếu tố làm tăng nguy cơ gout, song bạn có thể hỗ trợ đào thải chất này bằng những thói quen đơn giản trong sinh hoạt hằng ngày.

(GLO)- Bệnh viện Đa khoa trung tâm tỉnh Gia Lai vừa thông báo tổ chức chương trình khám bệnh từ thiện năm 2026 dành cho trẻ em bị sứt môi, hở hàm ếch, chỉnh âm và các dị tật vùng hàm mặt - tai mũi họng có hoàn cảnh khó khăn trên địa bàn tỉnh.
Ngày tết, rượu bia, chế độ ăn mặn và nhiều đạm không chỉ gây hại vì lượng dùng, mà còn khiến gan thận phải xử lý độc chất ở mức tế bào, âm thầm tích lũy tổn thương.

Chào đời rạng sáng mùng 1 Tết Bính Ngọ, bé trai Nguyễn Thế Minh Khôi nặng 3 kg trở thành công dân nhí đầu tiên tại Bệnh viện Phụ sản Trung ương.
(GLO)- Bộ Y tế vừa ban hành tài liệu chuyên môn “Hướng dẫn chẩn đoán và điều trị bệnh do virus Nipah” áp dụng thống nhất tại các cơ sở khám bệnh, chữa bệnh trên toàn quốc.

(GLO)- Măng khô là món ăn quen thuộc trong mâm cơm ngày Tết của người Việt. Dù bổ dưỡng, song với một số người, việc ăn măng khô có thể gây hại cho sức khỏe.

(GLO)- Levia Plus và Thăng Long là hai mẫu nước uống đóng chai trong danh sách sản phẩm không đạt chất lượng, có kết quả kiểm nghiệm không đạt chỉ tiêu vi sinh vật.


(GLO)- Nhằm thực hiện tốt nhiệm vụ dịp Tết Nguyên đán Bính Ngọ 2026, các bệnh viện trên địa bàn tỉnh Gia Lai đã chủ động xây dựng kế hoạch với mục tiêu bảo đảm đầy đủ các điều kiện cần thiết để bảo vệ sức khỏe nhân dân.

Người trên 50 tuổi bị huyết áp cao cần chú ý đến các thói quen buổi sáng. Đây là thời điểm huyết áp dễ biến động mạnh nhất trong ngày.

(GLO)- Sáng 6-2, Bệnh viện Lao và bệnh phổi Pleiku (tỉnh Gia Lai) và Bệnh viện Lao và bệnh phổi Quy Nhơn tổ chức Chương trình kết nghĩa và ký kết hợp tác toàn diện.

(GLO)- Không cần thay đổi quá lớn hay áp dụng chế độ khắc nghiệt, nhiều thói quen nhỏ trong sinh hoạt hằng ngày lại chính là “chìa khóa” giúp cơ thể khỏe mạnh, tinh thần tích cực và sống thọ hơn.
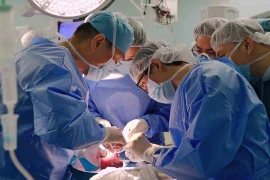
Các bác sĩ của Bệnh viện đa khoa quốc tế Vinmec Times City (gọi tắt: BV Vinmec Times City, Hà Nội) đã thực hiện thành công ca ghép gan cho bệnh nhi (BN) hơn 11 tháng tuổi ở Khánh Hòa, chỉ nặng 5,3 kg.

Khoai lang thường được nhiều người lựa chọn vào bữa sáng với mục tiêu giảm cân. Tuy nhiên, nếu ăn khoai lang không đúng cách hoặc kết hợp sai thời điểm, hiệu quả kiểm soát cân nặng có thể giảm đáng kể, thậm chí phản tác dụng.

(GLO)- Quả khế không chỉ góp phần tạo vị chua thanh cho món ăn, mà còn mang lại nhiều lợi ích cho sức khỏe nếu dùng hợp lý. Những giá trị dinh dưỡng của loại quả này đang ngày càng được nhiều người quan tâm.

(GLO)- Cục Quản lý Dược (Bộ Y tế) vừa ban hành công văn về việc đảm bảo cung ứng thuốc phòng - chống dịch bệnh và nhu cầu sử dụng thuốc trong dịp Tết Bính Ngọ 2026. Trong đó, Cục Quản lý Dược yêu cầu không để xảy ra tình trạng đầu cơ, lợi dụng dịp Tết để tăng giá thuốc.
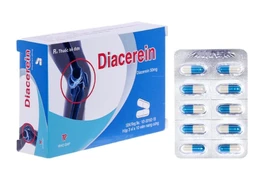
(GLO)- Cục Quản lý Dược (Bộ Y tế) vừa có thông báo thu hồi trên toàn quốc lô thuốc Viên nang cứng Diacerein 50 (Diacerein 50mg) vì không đạt tiêu chuẩn chất lượng về chỉ tiêu hàm lượng nước. Đây là loại thuốc thường được chỉ định trong điều trị thoái hóa khớp.


Bộ Y tế đề nghị địa phương tăng cường công tác giám sát, phòng chống dịch bệnh do virus Nipah ngay từ các cửa khẩu, cơ sở y tế và cộng đồng, sẵn sàng các biện pháp đáp ứng, phòng chống dịch.

(GLO)- Cục An toàn Thực phẩm yêu cầu các đơn vị kiểm soát, cảnh báo lô sản phẩm sữa công thức Aptamil Infant Formula 800g bị nhiễm độc đến người tiêu dùng.

(GLO)- Chuyên gia dinh dưỡng và huấn luyện viên sức khỏe tại Kolkata (Ấn Độ) Nikita Bardia vừa chia sẻ bí quyết phục hồi gan chỉ bằng thói quen uống cà phê đen đúng cách.

(GLO)- Nhiều loại cây cảnh được trồng phổ biến trong nhà và nơi công cộng nhờ vẻ ngoài bắt mắt. Tuy nhiên, ít người biết rằng một số loài trong số đó lại chứa độc tố, có thể gây hại cho sức khỏe, đặc biệt với trẻ nhỏ và vật nuôi.

(GLO)- Ngày 25-1, tại Bệnh viện đa khoa Trung tâm tỉnh Gia Lai (phường Quy Nhơn), Câu lạc bộ 25 Bình Định (thuộc Hội Chữ thập đỏ tỉnh Gia Lai) phối hợp với Ban chỉ đạo vận động hiến máu tình nguyện tỉnh tổ chức Lễ hội Xuân hồng năm 2026.

Trời lạnh khiến cơ thể mất nước qua hơi thở và mồ hôi nhanh, làm máu trở nên đặc và dễ hình thành cục máu đông, tăng nguy cơ đột quỵ.