 |
| Nguồn: Reuters |

 |
| Nguồn: Reuters |

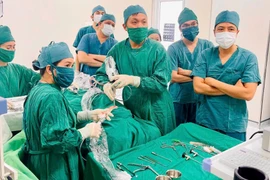





(GLO)- Ngày 25-1, tại Bệnh viện đa khoa Trung tâm tỉnh Gia Lai (phường Quy Nhơn), Câu lạc bộ 25 Bình Định (thuộc Hội Chữ thập đỏ tỉnh Gia Lai) phối hợp với Ban chỉ đạo vận động hiến máu tình nguyện tỉnh tổ chức Lễ hội Xuân hồng năm 2026.

Trời lạnh khiến cơ thể mất nước qua hơi thở và mồ hôi nhanh, làm máu trở nên đặc và dễ hình thành cục máu đông, tăng nguy cơ đột quỵ.

(GLO)- Nhiều gia đình có thói quen đun sôi nước rồi để nguội dùng dần trong nhiều ngày. Tuy nhiên, việc bảo quản và sử dụng nước đun sôi để lâu có thực sự an toàn hay không là điều không phải ai cũng hiểu đúng.

(GLO)- Từ các chương trình phẫu thuật mắt miễn phí do Bệnh viện Mắt tỉnh phối hợp với Hội Bảo trợ bệnh nhân nghèo và các nhà hảo tâm, nhiều trẻ em, người nghèo đã tìm lại ánh sáng và thêm cơ hội vươn lên trong cuộc sống.

(GLO)- Một cốc nước ấm pha mật ong vào buổi tối không chỉ giúp cơ thể thư giãn trước khi đi ngủ mà còn hỗ trợ làm dịu dạ dày và cải thiện chất lượng giấc ngủ. Vì vậy, thói quen này nên duy trì đều đặn mỗi ngày.

(GLO)- Quốc hội đã thông qua Luật Phòng bệnh số 114/2025/QH15 ngày 10-12-2025, đánh dấu bước chuyển căn bản của hệ thống y tế, tạo nền tảng quan trọng trong nâng cao sức khỏe nhân dân.
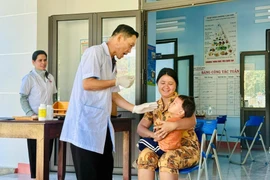
(GLO)- Thực hiện Dự án 7 “Chăm sóc sức khỏe nhân dân, nâng cao thể trạng, tầm vóc người dân tộc thiểu số; phòng, chống suy dinh dưỡng trẻ em” giai đoạn 2021-2025, tỉnh Gia Lai đã triển khai đồng bộ nhiều giải pháp chăm sóc sức khỏe cộng đồng tại cơ sở.

(GLO)- Ngồi làm việc nhiều giờ trước máy tính là đặc thù của dân văn phòng, song tư thế ngồi sai có thể gây đau lưng, mỏi cổ và ảnh hưởng lâu dài đến cột sống. Những mẹo ngồi đúng tư thế dưới đây giúp giảm áp lực cơ - xương - khớp và nâng cao hiệu quả làm việc.

(GLO)- Không chỉ là loại rau gia vị quen thuộc, húng quế còn mang lại nhiều lợi ích đáng chú ý cho sức khỏe. Từ hỗ trợ tiêu hóa, kháng khuẩn tự nhiên đến giúp giảm căng thẳng, loại rau dân dã này đang được giới chuyên gia đánh giá cao nếu sử dụng đúng cách.

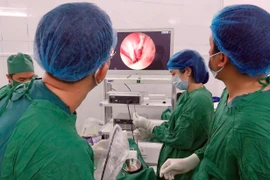

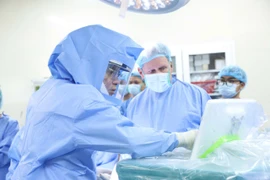
(GLO)- Ngày 15-1, các bác sĩ Bệnh viện Đại học Y Hà Nội đã thực hiện thành công ca phẫu thuật thay khớp gối toàn phần với sự hỗ trợ của robot CORI. Đây là lần đầu tiên Việt Nam ứng dụng robot trong điều trị cho người mắc bệnh thoái hóa khớp gối.

Các nhà khoa học vừa giải thích được lý do vì sao những người thường xuyên uống cà phê ít bị tiểu đường hơn.

(GLO)- Ăn cơm là sinh hoạt hằng ngày nhưng không phải ai cũng thực hiện đúng cách. Một số thói quen tưởng chừng vô hại trong bữa ăn lại có thể âm thầm gây ảnh hưởng đến hệ tiêu hóa, làm tăng nguy cơ mắc bệnh nếu duy trì trong thời gian dài.
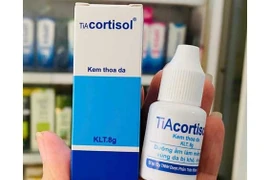
(GLO)- Cục Quản lý Dược (Bộ Y tế) yêu cầu thu hồi kem thoa da TiAcortisol do chứa chất bảo quản không công bố và nhãn ghi gây hiểu nhầm là thuốc chữa bệnh.

(GLO)- Tại Lễ công bố Top 10 công ty dược uy tín năm 2025 do Vietnam Report tổ chức ngày 8-1 tại Nhà hát Hồ Gươm (Hà Nội), Công ty Cổ phần Dược - Trang thiết bị Y tế Bình Định (Bidiphar) được vinh danh trong Top 4 công ty dược uy tín nhất Việt Nam.

Nestlé Việt Nam tự nguyện thu hồi phòng ngừa 17 lô sữa NAN sau khi phát hiện nguy cơ tiềm ẩn từ nguyên liệu dầu PUFA do đối tác châu Âu cung cấp.

Trong mùa lạnh có 3 thời điểm đặc biệt nhạy cảm, nguy cơ xảy ra đột quỵ tăng cao nếu người dân không chú ý phòng tránh.

(GLO)- Không chỉ là loại rau quen thuộc trong bữa ăn hàng ngày, lá mơ lông còn mang lại nhiều lợi ích thiết thực cho sức khỏe mà không phải ai cũng biết.

Một số lô sữa bột trẻ sơ sinh Beba, Alfamino của Nestlé bị thu hồi tại Đức do nghi nhiễm độc tố. Bộ Y tế yêu cầu rà soát việc lưu hành tại Việt Nam.



(GLO)- Theo Cục Quản lý Dược (Bộ Y tế), năm 2025, Việt Nam có 67 công ty dược xuất khẩu thuốc, nguyên liệu làm thuốc đạt 312 triệu USD, đứng thứ 4 trong khu vực Đông Nam Á.

(GLO)- Ủy ban nhân dân tỉnh Gia Lai vừa ban hành Quyết định số 3211/QĐ-UBND về việc xếp hạng lại các đơn vị sự nghiệp y tế công lập trực thuộc Sở Y tế.

Để tránh làm đường huyết tăng nhanh khi ăn khoai lang, bạn nên ghi nhớ và thực hiện nguyên tắc “3 không”.
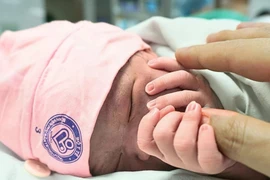
Đúng thời khắc giao thừa năm 2026, Bệnh viện Phụ sản TW đón bé gái đầu tiên của năm mới, chào đời an toàn, khỏe mạnh, mang theo niềm vui, hy vọng và khởi đầu ấm áp cho gia đình và đội ngũ y bác sỹ.

(GLO)- Theo kế hoạch của UBND tỉnh Gia Lai về bảo hiểm y tế (BHYT) toàn dân trong giai đoạn mới, tỉnh đặt mục tiêu mở rộng diện bao phủ BHYT, nâng cao chất lượng khám - chữa bệnh, tăng mức độ hài lòng của người dân.

(GLO)- Bộ Y tế vừa có quyết định ban hành Dược điển Việt Nam VI bao gồm 1.722 tiêu chuẩn quốc gia về thuốc. Dược điển này có hiệu lực từ ngày 1-7-2026, là căn cứ bắt buộc trong hoạt động kiểm nghiệm, đánh giá chất lượng thuốc và nguyên liệu làm thuốc.