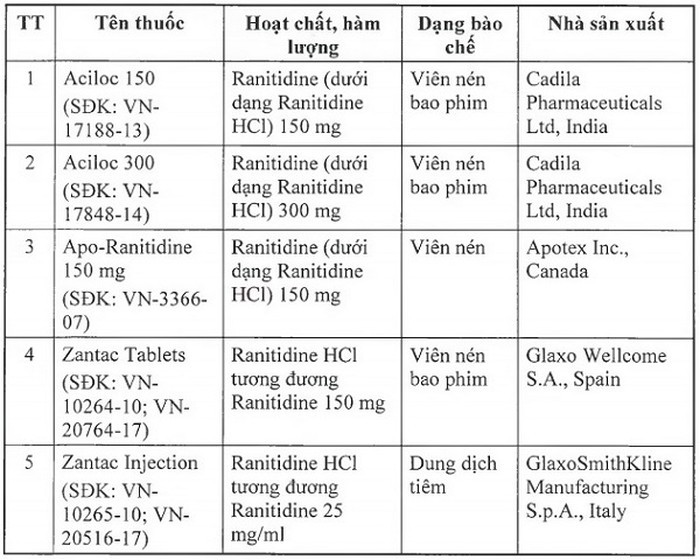
 |

 |








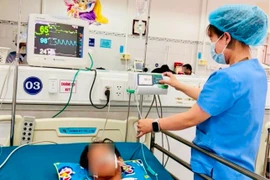
(GLO)- Ngày 5-3, thông tin từ Bệnh viện Nhi Gia Lai, đơn vị vừa tiếp nhận và điều trị thành công cho nam bệnh nhi tên Ng (12 tuổi, trú tại Kon Nak, xã Đak Sơ Mei, tỉnh Gia Lai) bị nhiễm vi khuẩn Burkhol cepacia hiếm gặp gây nhiều lỗ thủng ruột.

Bên cạnh thuốc và tập luyện thể chất, chế độ ăn uống cũng đóng vai trò quan trọng với kiểm soát mỡ máu. Một số loại nước ép trái cây, rau củ sẽ giúp giảm mỡ máu hiệu quả hơn.

(GLO)- Hoa chuối (bắp chuối) không chỉ là nguyên liệu chế biến các món ăn dân dã mà còn là vị thuốc quý với tác dụng ít ngờ: cải thiện tắc tia sữa, khắc phục chứng táo bón, hỗ trợ giảm cân, chống trầm cảm và cải thiện tâm trạng.

Từ lâu, giá đỗ được biết đến là thực phẩm tốt cho sức khỏe. Việc sử dụng giá đỗ đúng cách sẽ giúp cơ thể tận dụng tối đa giá trị dinh dưỡng.

(GLO)- Các nghiên cứu dinh dưỡng đã chứng minh lá củ cải trắng là một "siêu thực phẩm", bởi chứa hàm lượng vitamin và khoáng chất cao gấp nhiều lần so với phần củ. Thế nhưng, lâu nay, chúng vẫn bị vứt bỏ, ít được sử dụng.

(GLO)- Ngày 3-3, tại Nhật Bản, đại diện lãnh đạo Hệ thống Y tế Hùng Vương đã chính thức ký kết Thỏa thuận hợp tác với Tập đoàn Y tế Seishokai - một đơn vị uy tín, giàu kinh nghiệm trong lĩnh vực y tế tại Nhật Bản.

(GLO)- Ngày 3-3, tại phường Quy Nhơn Bắc, Hội Đông y tỉnh Gia Lai phối hợp với Bệnh viện Y học cổ truyền và phục hồi chức năng Quy Nhơn tổ chức lễ dâng hương tưởng niệm 235 năm ngày mất Đại danh y Hải Thượng Lãn Ông - Danh nhân Văn hóa thế giới Lê Hữu Trác (1724-1791).

(GLO)- Gan nhiễm mỡ là một căn bệnh tiềm ẩn nguy hiểm nếu không được phát hiện và điều trị kịp thời. Việc nhận diện sớm các dấu hiệu cảnh báo gan nhiễm mỡ và có những biện pháp khắc phục sẽ giúp tránh được nguy cơ biến chứng.

(GLO)- Cùng với hệ thống y tế công lập, hệ thống y tế tư nhân trên địa bàn tỉnh Gia Lai đang góp phần vào công tác chăm sóc sức khỏe nhân dân.




(GLO)- Thận là cơ quan thầm lặng nhưng quyết định sự ổn định của cơ thể. Thói quen dùng một số loại đồ uống tưởng chừng vô hại như nước ngọt, rượu bia, trà đặc hay nước tăng lực lại có thể khiến thận phải “làm việc quá sức”, lâu dần gây suy giảm chức năng.

(GLO)- Sáng 1-3, tại phường Diên Hồng (tỉnh Gia Lai) đã diễn ra Lễ ký kết hợp tác chuyên môn giữa Bệnh viện Quân y 211 và Bệnh viện Mắt Quốc tế Sài Gòn - Gia Lai.

(GLO)- Cà phê giúp tỉnh táo và tăng hiệu suất làm việc nhưng lại có thể làm giảm khả năng hấp thu một số vitamin và khoáng chất nếu dùng không đúng thời điểm. Những tương tác kỵ nhau này dễ khiến cơ thể thiếu hụt vi chất cần thiết mà nhiều người không nhận ra.

(GLO)- Không chỉ là gia vị quen thuộc trong gian bếp, hạt tiêu còn được xem là “kho dược liệu” tự nhiên với nhiều công dụng quý cho sức khỏe. Từ hỗ trợ tiêu hóa, kháng viêm, tăng cường miễn dịch đến thúc đẩy hấp thu dưỡng chất, loại gia vị nhỏ bé này mang lại giá trị lớn nếu được sử dụng đúng cách.
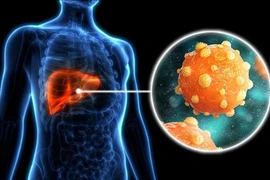
(GLO)- Tập đoàn Dược phẩm và Sinh học đa quốc gia GlaxoSmithKline (GSK) vừa nộp hồ sơ xin cấp phép lưu hành thuốc bepirovirsen sodium lên Bộ Y tế, Lao động và Phúc lợi Nhật Bản. Đây là liệu pháp mới được kỳ vọng giúp bệnh nhân viêm gan B có thể ngừng thuốc mà vẫn kiểm soát được virus.
(GLO)- Ủy ban Nhân dân tỉnh Gia Lai vừa ban hành Kế hoạch số 68/KH-UBND về việc bảo vệ, chăm sóc và nâng cao sức khỏe nhân dân năm 2026; trong đó, phấn đấu 100% trạm y tế xã, phường có bác sĩ.

(GLO)- Vụ Bảo hiểm y tế (Bộ Y tế) đang xây dựng bổ sung danh mục thuốc hóa dược và sinh phẩm chi trả bảo hiểm y tế (BHYT). Theo đề xuất, 84 loại thuốc, trong đó có 30 thuốc điều trị ung thư, sẽ được bổ sung vào danh mục.
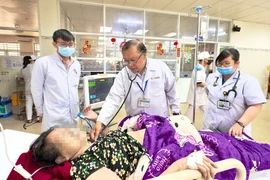
(GLO)- Ủy ban nhân dân tỉnh Gia Lai vừa ban hành Quyết định số 688/QĐ-UBND phê duyệt chủ trương đầu tư Dự án xây dựng khu hành chính thuộc Bệnh viện Đa khoa Gia Lai.

(GLO)- Sáng 27-2, Bệnh viện Nhi tỉnh Gia Lai (phường Pleiku) tổ chức tọa đàm kỷ niệm 71 năm Ngày Thầy thuốc Việt Nam (27/2/1955-27/2/2026) với chủ đề: “Ngành Y tế tỉnh Gia Lai vững bước vì sức khỏe Nhân dân”.




(GLO)- Nhân kỷ niệm 71 năm Ngày Thầy thuốc Việt Nam (27/2/1955 - 27/2/2026), chiều 26-2, Phó Chủ tịch UBND tỉnh Nguyễn Thị Thanh Lịch đã đến thăm, chúc mừng đội ngũ y bác sĩ, nhân viên y tế tại Bệnh viện Đa khoa Trung tâm tỉnh và Bệnh viện Phong - Da liễu Trung ương Quy Hòa.

(GLO)- Ngày 26-2, thông tin từ Bệnh viện Đại học Y Dược - Hoàng Anh Gia Lai cho hay: Đơn vị vừa tiếp nhận cấp cứu thành công cho bé T.A. (SN 2023, phường Diên Hồng, tỉnh Gia Lai) nhập viện trong tình trạng nôn ói, ho sặc sụa, thở mệt do nuốt nhầm dầu thơm.
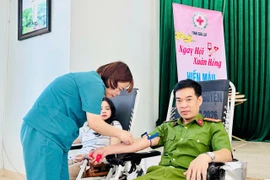
(GLO)- Ngày 26-2, tại làng Kép (phường Thống Nhất), Ban Chỉ đạo vận động hiến máu tình nguyện tỉnh Gia Lai phối hợp với UBND phường Thống Nhất tổ chức Lễ hội Xuân hồng đợt thứ 2 - 2026.

(GLO)- Từ loại rau gia vị quen thuộc, rau ngổ đang được nhiều người quan tâm nhờ khả năng hỗ trợ tiêu hóa, thanh nhiệt và lợi tiểu. Bổ sung đúng cách trong bữa ăn có thể mang lại nhiều lợi ích thiết thực cho sức khỏe.

Thay vì cố “chữa cháy” bằng quá nhiều sản phẩm cùng lúc, bạn hãy gội nhẹ nhàng, dưỡng ẩm đủ, hạn chế nhiệt và hóa chất – bốn nguyên tắc tưởng đơn giản nhưng hiệu quả lâu dài.

(GLO)- Với tinh thần chủ động, sẵn sàng, vì nhân dân phục vụ, dịp Tết Nguyên đán Bính Ngọ 2026, ngành Y tế tỉnh đã ứng trực, triển khai thực hiện tốt nhiệm vụ, góp phần đem đến một mùa xuân an lành cho cộng đồng.